2013年、欧州と米国で、放射性同位元素(ラジオアイソトープ・RI)のRa-223(塩化ラジウム)が、骨転移のある去勢抵抗性前立腺がん(男性ホルモンの分泌を抑える治療を行なっているにも関わらず悪化する前立腺がん)の治療薬として承認された。骨転移にまで進行した前立腺がんの患者さんの生存期間を延ばし、QOLを高める注射薬だ。
高エネルギーのα線でがん細胞をたたくが、副作用は少ない治療
開発した独バイエル社は、「ゾーフィゴⓇ」の商品名でこの治療薬の発売を開始。米国での2014年度の販売額は2億ドル(当時で約250億円)を超え、市場規模が大きくない放射性薬剤としては、初のブロックバスター薬剤となった。
ブロックバスターとは、まったく新しい市場の開拓と莫大な売り上げで、開発費を上回る利益を生み出す画期的新薬の代名詞として知られる。日本では16年3月に承認され、6月に保険適用となった。患者さん向けのサイトからアクセスできる医療機関が、全国で288カ所(2018年6月末時点)に増えているという。
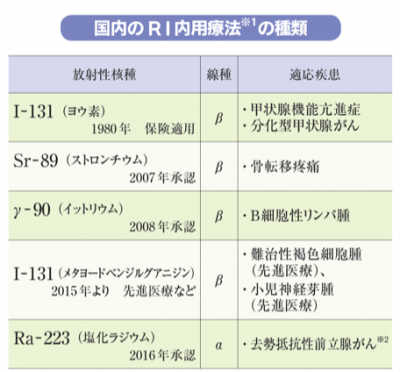
表は、国内のRI内用療法に用いる放射性核種(種類)と、その放出線種を示す。Ra-223は、骨への転移で骨代謝が活発な部分に取り込まれてα線を放出するが、がん細胞のDNAの一重鎖しか切断できないβ線に対し、DNAの二重鎖を断ち切ることで、がん細胞を修復不能の状態にする。α線のエネルギーが400倍も高いためだ。
また、放出される放射線の飛距離を比較した場合、Sr-89のβ線が2.4ミリであるのに対し、Ra-223のα線は0.1ミリ以下とケタ違いに短い。Ra-223のα線は、周囲の骨髄など正常組織への影響が少ないため、免疫力の低下を抑えられる。
こういった特徴を背景に、国内外の二重盲検試験(薬効のある被検薬と薬効のないプラセボの区別を医師にも患者さんにも分からないようにして実施する臨床試験)では、プラセボを用いた対照群に比べ、生存期間を平均で3.6カ月延ばす効果と、副作用が少ないことも認証されている。
Ra-223を割り当てられた群の治療成績がよいため、臨床試験中に、プラセボを使っていた対照群の被験者(患者さん)のプラセボ使用を中止し、Ra-223に切り替えたケースもある。それほど高い効き目を示していた。「α線による治療の切れ味がよく、副作用も低い」(細野眞 近畿大教授=核医学)と、関係者から驚きの声が上ったほどだ。10年以上前までは研究段階にとどまっていたα線の利用が、RI内用療法の主流に躍り出る可能性もある。
従来からの内用療法も進化。対象患者さんは増加傾向に
一方、長い歴史をもつβ線によるRI内用療法は、がんなどを標的細胞とした有力な治療法であることに変わりはない。放射性ヨウ素治療は、バセドー病や甲状腺がんを対象に1940年代に米国で始まり、日本に早くから導入。80年に保険適用された。だが、β線以外に高エネルギーのγ線を放出するために周囲の人の防護目的で投与量の限度が決められたり、RI病棟建設のコストアップによる病床数の減少、さらに診療報酬が低めに抑えられてきたこともあって、一時下火になった時代もあった。しかし、ここ数年、有用性が高く評価される内用療法の患者さんは確実に増加傾向にある。
表中のI-131(メタヨードベンジルグアニジン)に関しては、難治性褐色細胞腫を対象に、先進医療として金沢大学をはじめ国内4大学で治療が行われている。抗がん剤治療の効果がない患者さんたちの最後の砦でもある。絹谷清剛同大教授(核医学)らは、次のステップとして企業治験を支援し、薬事承認申請を目指している。2018年6月現在、神経芽腫についても先進医療として研究が進められている。
前述のα線種についても、新たな核種の研究開発が世界的に進み、欧米では複数のがん種の臨床試験を開始。日本はマウスによる基礎研究の段階だが、海外とのコラボによる実用化に期待したい。
医事ジャーナリスト(取材時現在)

