
2016年のノーベル生理学・医学賞受賞者が発表された10月3日以降、「オートファジー」という言葉が世間で認知されるようになってきた。「生物が細胞内でタンパク質を分解して再利用する現象」で、ギリシャ語の「自己」を表す「auto」と、「食べる」の「phagy」を組み合わせた合成語。日本語に訳すと「自食作用」となる。
ここ15年で研究が進み論文の数は60倍に
1963年、ロンドンでの学会で、初めてこの専門用語が科学分野に登場する。ベルギーのド・デューブ博士が、マウスの臓器で見つけたこの現象を報告、発表した。博士は別の業績で74年にノーベル賞を受賞。今回、オートファジーでノーベル賞に輝いた大隅良典東工大栄誉教授の受賞理由は、「細胞がその中身をリサイクルする方法について新たなパラダイム(枠組み)をもたらし、飢餓や感染に対し、細胞がどう適応しているかを理解する道を開いた」ことにある。
大隅博士は44歳のとき、東大教養学部助教授として、たった1人の研究室を立ち上げた。顕微鏡で飢餓状態の酵母をのぞいていると、キラキラした小さな粒が踊るように飛び跳ねているのが見えた。「何か新しい現象が起きているのでは」。世界で初めて、肉眼でオートファジーを観察した瞬間だった。その後、酵母の遺伝学を駆使し、オートファジーを引き起こす遺伝子を次々に発見したが、学会であまり注目されなかった。
だが、97年ごろからすぐれた共同研究者らにも恵まれ、生物学としてのオートファジーの研究基盤が確立されていく。今世紀に入ると、様々な病気の治療に向けた医学研究分野にも急速に広がった。2015年の論文数は5000本を超えた。15年前の約60倍、10年前の約20倍という成長ぶりだ。
がん治療の基本戦略はオートファジーの抑制
人間の体は60兆個ともいわれる細胞からできており、絶えず新しい細胞に生まれ変わっている。オートファジーは栄養素の確保や、細胞内に生じた不要なタンパク質・細胞内小器官(ミトコンドリアなど)の除去のために恒常的に分解と再利用を繰り返す。成人の体内では、1日に約200グラムのタンパク質が作られるが、食事から得られるのは60~80グラムに過ぎない。不足分は主にオートファジーで分解した自身のタンパク質が原料となる。病気や老化の原因となる不要なタンパク質もリサイクルして活用している。
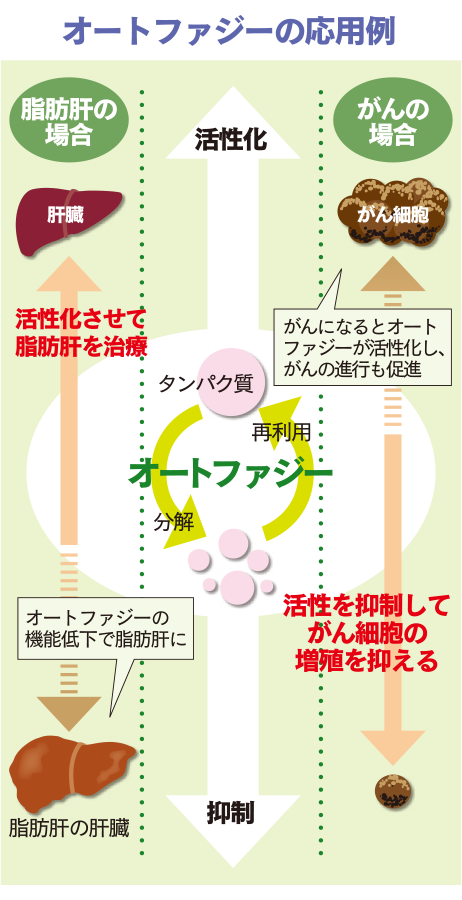
図は、がん治療にも関係するオートファジーの応用例の一部を示している。がんになると、がん細胞に栄養を与える代謝活動が活発になり、オートファジーは活性化する。つまり、正常細胞では役立つオートファジーだが、がん細胞では、がんの進行を促進することになる。そこで、「正常細胞に影響を与えない範囲」で、オートファジー活性を抑制(阻害)することが基本戦略になる。
一方、アルツハイマー病、パーキンソン病、神経性難病など、細胞内に異常なタンパク質やミトコンドリアが蓄積して起こる疾患に対しては、オートファジーを活性化させる治療法が効果的であることが、動物実験で多数報告されている。脂肪肝もオートファジーの機能低下により処理されるはずのゴミがたまって起こるため、やはり活性化させる治療が必要になる。
このようなオートファジーの特徴を考慮したうえで、抗がん剤の臨床試験やスクリーニングが世界中で行われており、動物レベルで効果が確認されている薬剤もある。ただ、薬効を判定できるマーカー(指標)がなく、阻害あるいは亢進による副作用についても、現時点では不明のようだ。
しかし、今回のノーベル賞受賞を機に、オートファジー研究、各種疾患の治療に向けた開発に加速がつくことは間違いないだろう。
(2017年1月時点)
医事ジャーナリスト・埼玉医科大学客員教授(取材時現在)

